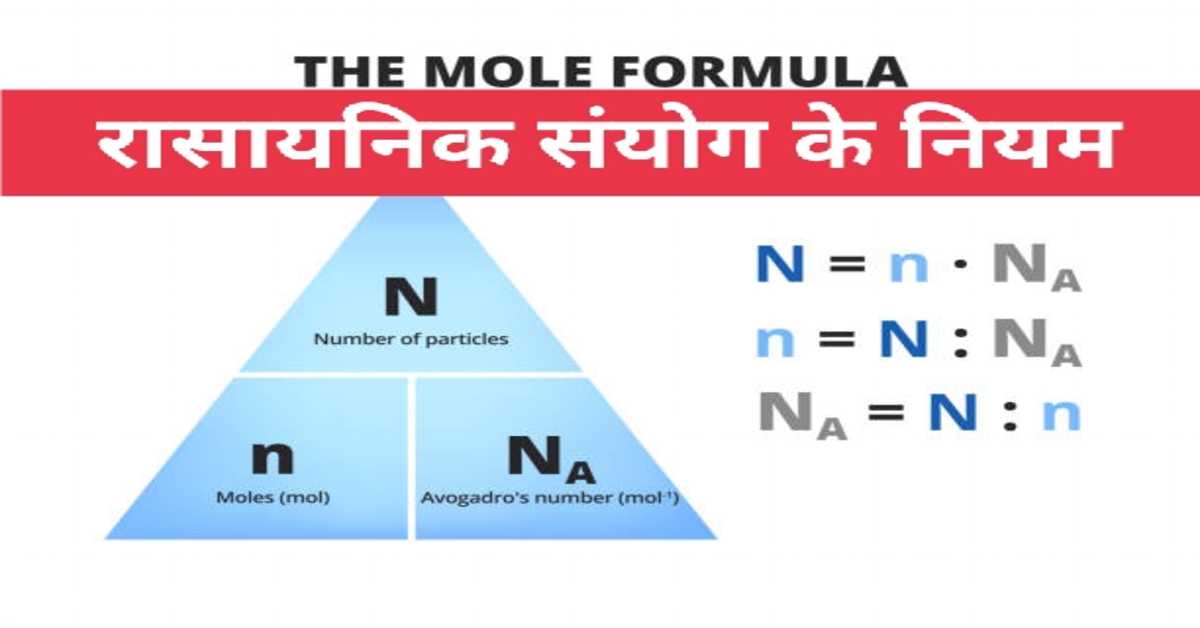
रासायनिक संयोग के नियम | Laws of Chemical Combination
रसायन विज्ञान के रासायनिक संयोग के नियम निम्नलिखित हैं-
1. द्रव्य के संरक्षण का नियम।
2. स्थिर या निश्चित अनुपात का नियम।
3. गुणित अनुपात का नियम।
4. गैलूसेक का नियम। ( गैसीय संयोजन का नियम)
5. आवोगाद्रो का नियम
The following are the laws of chemical combination of chemistry-
1. Law of conservation of matter.
2. Law of fixed or fixed proportion.
3. Law of Multiple Proportions.
4. Gallusek's law. (law of gaseous combination)
5. Avogadro's Law
द्रव्य के संरक्षण का नियम- इस नियम को रूसी वैज्ञानिक लोमोनोसो ने प्रतिपादित किया था तथा बाद में इसकी पुष्टि लैंडोल्ट व लेवोजिए ने की थी। इस नियम के अनुसार "रासायनिक अभिक्रिया में भाग लेने वाले पदार्थों की मात्राओं का योग रासायनिक अभिक्रिया से बने पदार्थों की मात्राओं के योग के बराबर है। अर्थात् रासायनिक अभिक्रिया में द्रव्य न तो उत्पन्न होता है और न ही नष्ट होता है।" इसे पदार्थ की 'अविनाशिता का नियम' भी कहते हैं।
उदाहरण- 12 ग्राम कार्बन 32 ग्राम ऑक्सीजन से संयोग कर 44 ग्राम कार्बन डाइऑक्साइड बनाती है।
C (12 gm) + O2 (32 gm) = CO2 (44 gm)
Law of conservation of matter- This law was propounded by Russian scientist Lomonoso and later confirmed by Landolt and Levozie. According to this law, "the sum of the quantities of substances that take part in a chemical reaction is equal to the sum of the quantities of the substances formed by a chemical reaction.That is, matter is neither created nor destroyed in a chemical reaction." It is also called 'law of indestructibility' of matter.
Example- 12 grams of carbon combines with 32 grams of oxygen to form 44 grams of carbon dioxide.
C (12 gm) + O2 (32 gm) = CO2 (44 gm)
रसायन विज्ञान के इन 👇 प्रकरणों को भी पढ़ें।
1. रसायन विज्ञान की प्रमुख शाखाएँ, विभिन्न क्षेत्रों में योगदान और शोध व अध्ययन के संस्थान
2. रसायनज्ञ- डॉ. प्रफुल चंद राय, डॉ. हरगोविंद सिंह खुराना, लेवोजिए
3. डाल्टन का परमाणु वाद एवं इसकी अवधारणाएँ
4. आधुनिक परमाणुवाद तथा अणु और परमाणु में अंतर
लैण्डोल्ट का प्रयोग- लैण्डोल्ट ने 15 वर्षों तक अनेक रासायनिक अभिक्रियाओं का अध्ययन किया। उन्होंने अपने प्रयोग में अभिकारकों (AgNO3 व KCl) को भर दिया तथा नलियों के मुँह को बंद कर दिया। अभिकारकों से भरे पात्र को तौल लिया। उपकरण को उलट कर दोनों विलयनों को मिला दिया। अभिक्रिया के बाद उपकरण ठंडा करके पुनः तौला गया। अभिक्रिया के पूर्व तथा अभिक्रिया के बाद के द्रव्यमानों में कोई अंतर नहीं आया। अतः उन्होंने स्पष्ट किया कि इस प्रयोग से द्रव्य के संरक्षण नियम की पुष्टि होती है।
AgNO3 + KCl = AgCl + KNO3
Landolt's Experiment-Landolt studied many chemical reactions for 15 years. In his experiment, he filled the reactants (AgNO3 and KCl) and closed the mouth of the tubes. Weigh the container full of reactants. Mix the two solutions by inverting the instrument. After the reaction, the apparatus was cooled and weighed again. There was no difference between the mass before and after the reaction. So he clarified that this experiment confirms the law of conservation of matter.
AgNO3 + KCl = AgCl + KNO3
स्थिर या निश्चित अनुपात का नियम- इस नियम को वैज्ञानिक जोसेफ लुई प्राउस्ट ने दिया था। इस नियम के अनुसार "रासायनिक यौगिकों में उनके अवयवी तत्व भार की दृष्टि से सदैव एक निश्चित अनुपात में रहते हैं।"
वैज्ञानिक प्राउस्ट ने यह सिद्ध किया कि किसी यौगिक को किसी भी विधि द्वारा बनाया जाए उसमें उपस्थित अवयवी तत्वों का अनुपात निश्चित रहता है।
उदाहरण- विभिन्न स्थानों से प्राप्त जल जैसे नदी, तालाब, कुँआ, प्रयोगशाला में हाइड्रोजन और ऑक्सीजन के संयोग से बना जल, रासायनिक अभिक्रियाओं में उपउत्पाद के रूप में बना जल।
इन समस्त स्रोतों से प्राप्त जल में हाइड्रोजन और ऑक्सीजन का अनुपात 2ः16 या 1ः8 होता है।
Law of constant or fixed proportion- This law was given by scientist Joseph Louis Proust. According to this law, "the constituent elements of chemical compounds are always in a definite ratio in terms of mass."
Scientist Proust proved that the proportion of constituent elements present in a compound remains fixed by any method.
Example- Water obtained from various places like river, pond, well, water formed by the combination of hydrogen and oxygen in laboratory, water formed as a by-product in chemical reactions.
The ratio of hydrogen and oxygen in water obtained from all these sources is 2:16 or 1:8.
भौतिकी विज्ञान के इन 👇 प्रकरणों को भी पढ़ें।
1. भौतिक राशियाँ और उनके मात्रक
2. प्रमुख भौतिक शास्त्री एवं उनका योगदान
3. न्यूटन के गति के नियम
4. भौतिकी के प्रमुख उपकरण एवं उनके आविष्कारक
गुणित अनुपात का नियम- इसे वैज्ञानिक जॉन डाल्टन ने प्रस्तुत किया था। इसके अनुसार "जब दो तत्व आपस में संयोग करके दो या दो से अधिक यौगिक बनाते हैं तो एक तत्व के भिन्न-भिन्न द्रव्यमान जो दूसरे तत्वों के निश्चित द्रव्यमान से संयोग करते हैं सदैव सरल अनुपात में होते हैं।"
उदाहरण- नाइट्रोजन के पाँच ऑक्साइडों का बनना।
नाइट्रोजन के ऑक्साइड- नाइट्रोजन और ऑक्सीजन का भारानुसार अनुपात- ऑक्सीजन का भारानुसार अनुपात
1. नाइट्रस ऑक्साइड (N2O)- 28ः16 या 14ः8- 1
2. नाइट्रिक ऑक्साइड (NO)- 14ः16- 2
3. नाइट्रोजन ट्राई ऑक्साइड (N2O3)- 28ः48 या 14ः24- 3
4. नाइट्रोजन टेट्रा ऑक्साइड (N2O4)- 28ः64 या 14ः32- 4
5. नाइट्रोजन पेन्टा ऑक्साइड (N2O5)- 28ः80 या 14ः40- 5
ऑक्सीजन के विभिन्न द्रव्यमान 8, 16, 24, 32, 40 जो नाइट्रोजन के एक निश्चित द्रव्यमान 14 संयोग होते हैं, 1, 2, 3, 4, 5 के सरल अनुपात में है।
The Law of Multiple Proportions- It was introduced by the scientist John Dalton. According to it "When two elements combine to form two or more compounds, the different masses of one element which combine with the fixed masses of the other elements are always in simple proportion."
Example- Formation of five oxides of nitrogen.
Oxides of Nitrogen- Weight by weight ratio of Nitrogen and Oxygen- Weight by weight ratio of Oxygen
1. Nitrous oxide (N2O)- 28:16 or 14:8- 1
2. Nitric Oxide (NO)- 14:16- 2
3. Nitrogen Tri Oxide (N2O3)- 28:48 or 14:24- 3
4. Nitrogen tetra oxide (N2O4)- 28:64 or 14:32- 4
5. Nitrogen penta oxide (N2O5)- 28:80 or 14:40- 5
The different masses of oxygen are 8, 16, 24, 32, 40 which combine to form a fixed mass of nitrogen 14, in the simple ratio 1, 2, 3, 4, 5.
इन 👇परीक्षापयोगी प्रकरणों के बारे में भी जानें।
1. जांतव रेशे
2. प्राणियों में पोषण- पाचन तंत्र
3. पादपों में पोषण- प्रकाश संश्लेषण
4. विज्ञान की शाखाएँ-जीवधारियों का नामकरण व वर्गीकरण
5. पारिस्थितिकी तंत्र जैविक एवं अजैविक घटक
6. रक्त का विज्ञान
गैलूसेक का गैसीय नियम- इसे वैज्ञानिक जोसेफ जुई गैलूसेक ने प्रस्तुत किया था। इस नियम के अनुसार "जब गैसें आपस में संयोग करती हैं तो उनके आयतनों में सरल अनुपात होता है। यदि उनके संयोग से बना हुआ पदार्थ भी गैस हो तो उसका आयतन भी क्रियाकारी गैसों के आयतनों के सरल अनुपात में होता है। (जबकि आयतन एनटीपी पर नापा जाए)"
उदाहरण- हाइड्रोजन का एक आयतन क्लोरीन के एक आयतन से संयोग कर दो आयतन हाइड्रोजन क्लोराइड (HCl) बनाते हैं। इसमें अभिकारक एवं उत्पाद सभी गैसें हैं। अतः इनमें हाइड्रोजन, क्लोरीन व हाइड्रोजन क्लोराइड गैस में परस्पर 1ः1ः2 का सरल अनुपात है।
H2 (1 mole, 1 vol) + Cl2 (1 mole, 1 vol) = 2HCl (2 mole, 2 vol)
Gaseous Law of Gallusek - It was introduced by scientist Joseph Jui Gallusek. According to this law "when gases combine with each other, their volumes are in simple ratio. If the substance formed by their combination is also a gas, then its volume is also in the simple ratio of the volumes of the reacting gases. (whereas volume is measured at NTP)"
Example- One volume of hydrogen combines with one volume of chlorine to form two volumes of hydrogen chloride (HCl). The reactants and products are all gases. Hence, hydrogen, chlorine and hydrogen chloride gas have a simple ratio of 1:1:2 among themselves.
H2 (1 mole, 1 vol) + Cl2 (1 mole, 1 vol) = 2HCl (2 mole, 2 vol)
आवोगाद्रो का नियम- आवोगाद्रो के अनुसार "समान ताप व दाब पर समस्त गैसों के समान आयतन में अणुओं की संख्या समान होती है"
वैज्ञानिक आवोगाद्रो ने एक ग्राम परमाणु या एक ग्राम अणु या एक ग्राम आयन में उपस्थित क्रमशः परमाणुओं या अणुओं या आयनों की संख्या को आवोगाद्रो संख्या कहा। इसे NA या L से दर्शाते हैं। इसका गणितीय मान 6.0221367 × 10 की घात 23 होता है। इसे संक्षेप में 6.022 × 10 की घात 23 लिखते हैं।
Avogadro's Law - According to Avogadro "All gases at the same temperature and pressure have the same number of molecules in the same volume"
Scientist Avogadro called Avogadro number the number of atoms or molecules or ions present in a gram atom or a gram molecule or a gram ion respectively. It is denoted by NA or L. Its mathematical value is 6.0221367 × 10 to the power 23. This is briefly written as 6.022 × 10 to the power 23.
इन 👇ज्ञानवर्धक प्रकरणों को भी पढ़ें।
1. आती छींक रोकना नुकसानदेह हो सकता है
2. प्याज काटने पर आँखों में जलन और आँसू क्यों आते हैं?
3. खुजलाने पर सुख की अनुभूति क्यों होती है
4. नाखून क्यों और प्रतिदिवस कितने बढ़ते हैं?
5. दर्द का अहसास क्यों और कैसे होता है?
आशा है, उपरोक्त जानकारी परीक्षार्थियों / विद्यार्थियों के लिए ज्ञानवर्धक एवं परीक्षापयोगी होगी।
धन्यवाद।
RF Temre
infosrf.com
संबंधित जानकारी नीचे देखें।
(Watch related information below) 👇🏻

आशा है, उपरोक्त जानकारी उपयोगी एवं महत्वपूर्ण होगी।
(I hope the above information will be useful and important. )
Thank you.
लेखक
(Writer)
infosrf.com








(Teacher)
Posted on September 25, 2021 02:09AM from ,
Rahul DHA kad
(Teacher)
Posted on September 24, 2021 08:09AM from ,
Gugol is helpful student life